El déficit de alfa-1 antitripsina (DAAT) es una enfermedad genética
La AAT es una proteína codificada por un gen conocido como SERPINA11. Hay muchas variantes genéticas o alelos de SERPINA1, pero los que más comúnmente se asocian al déficit grave incluyen los alelos PiS, PiZ y Pi(null).1,2
Alelos Pi más comunes del gen SERPINA1*,†1,2
| Alelos del gen SERPINA1 | Fenotipo de la proteína |
|---|---|
| PiM | Normal |
| PiS | La proteína se degrada en las células |
| PiZ | La proteína se acumula en las células |
| Pi(null) | No se produce proteína |
El déficit de AAT es una enfermedad autosómica codominante causada por la herencia de dos alelos con déficit de SERPINA1, que provoca un déficit de la proteína AAT en el suero sanguíneo y los pulmones.1,2
El déficit de AAT es uno de los trastornos hereditarios más prevalentes y graves del mundo3,4
Déficit de AAT: no es tan raro como parece
Tipo de transmisión hereditaria del déficit de AAT
Ejemplo 1:
Si un progenitor tiene dos alelos PiM (genotipo PiMM) y otro progenitor tiene dos alelos PiZ (genotipo PiZZ), el 100 % de sus hijos serán portadores heterocigóticos del alelo PiZ.
| hide | hide | GENOTIPO PROGENITOR 1 | |
|---|---|---|---|
| hide | hide | PiM | PiM |
| GENOTIPO PROGENITOR 2 | PiZ | PiMZ | PiMZ |
| PiZ | PiMZ | PiMZ | |
Ejemplo 2:
Si ambos progenitores son portadores heterocigóticos de PiZ (genotipo MZ), hay un 25 % de probabilidades de que un hijo padezca déficit de AAT (genotipo PiZZ), un 50 % de probabilidades de que sea portador heterocigótico (genotipo PiMZ) y un 25 % de probabilidades de que tenga un genotipo «normal» (genotipo PiMM).
| hide | hide | GENOTIPO PROGENITOR 1 | |
|---|---|---|---|
| hide | hide | PiM | PiZ |
| GENOTIPO PROGENITOR 2 | PiM | PiMM | PiMZ |
| PiZ | PiMZ | PiZZ | |
Las pruebas séricas por sí solas no son una herramienta de diagnóstico para el déficit de AAT
Aunque la concentración media de AAT en suero está asociada al genotipo (véase Relación entre los genotipos y las concentraciones medias de AAT en suero), los niveles de AAT fluctúan porque es una proteína de fase aguda.5
Por consiguiente, hay una superposición de las concentraciones medias entre los genotipos, en particular si el déficit es intermedio, de modo que las pruebas séricas por sí solas no son suficientemente específicas para diagnosticar el déficit de AAT.5 Además, las pruebas de suero pueden sobrestimar las concentraciones de AAT hasta en un 35-40 %.2
Relación entre los genotipos y las concentraciones medias de AAT en suero‡
Rango de niveles séricos de AAT por fenotipo
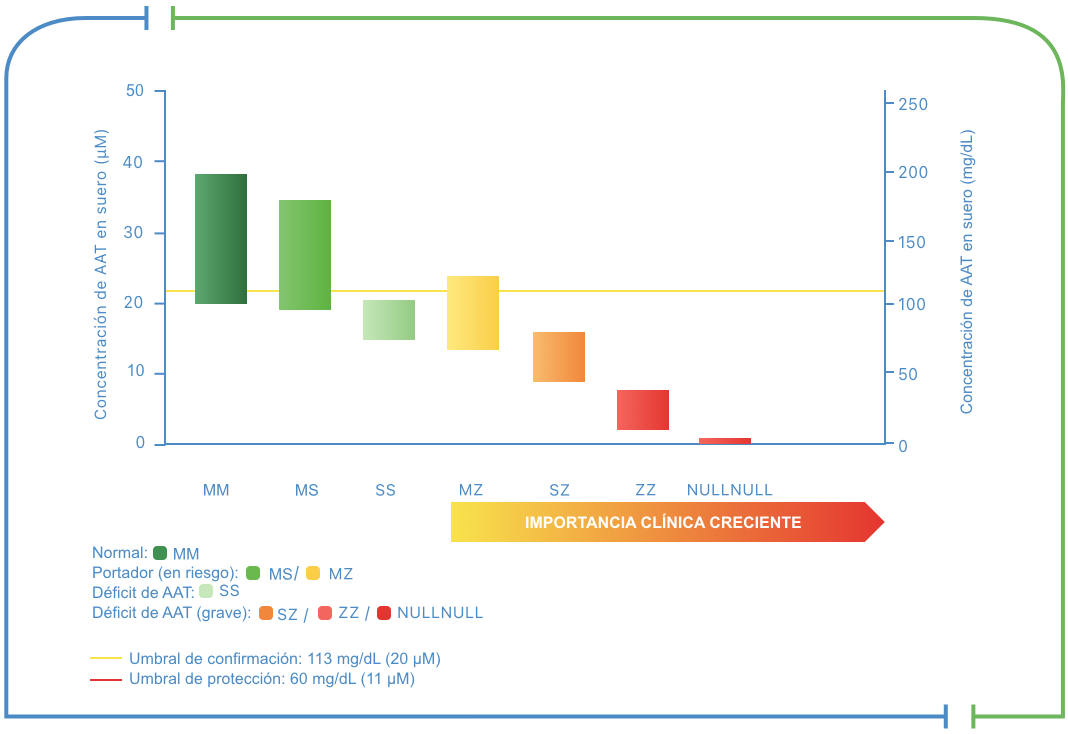
Las pruebas de laboratorio (tales como el genotipado y fenotipado) son la única manera de diagnosticar con precisión el déficit de AAT.1
Referencias
- Köhnlein T, Welte T. Alpha-1 antitrypsin deficiency: pathogenesis, clinical presentation, diagnosis, and treatment. Am J Med. 2008;121(1):3-9.
- ATS, ERS. American Thoracic Society/European Respiratory Society statement: standards for the diagnosis and management of individuals with alpha-1 antitrypsin deficiency. Am J Respir Crit Care Med. 2003;168(7):818-900.
- de Serres FJ, Blanco I. Prevalence of α1-antitrypsin deficiency alleles PI*S and PI*Z worldwide and effective screening for each of the five phenotypic classes PI*MS, PI*MZ, PI*SS, PI*SZ, and PI*ZZ: a comprehensive review. Ther Adv Respir Dis. 2012 Oct;6(5):277-95. doi: 10.1177/1753465812457113. Epub 2012 Aug 29. PMID: 22933512.
- Campos MA, Wanner A, Zhang G, et al. Trends in the diagnosis of symptomatic patients with alpha1-antitrypsin deficiency between 1968 and 2003. Chest. 2005;128(3):1179-86.
- Miravitlles M, Dirksen A, Ferrarotti I, et al. European Respiratory Society statement: diagnosis and treatment of pulmonary disease in α1-antitrypsin deficiency. European Respiratory Journal. 2017;50(5).
- Vidal R, Blanco I, Casas F, et al. Guidelines for the diagnosis and management of alpha-1 antitrypsin deficiency. Arch Bronconeumol. 2006;42(12):645-59.
- Topic A, Alempijevic T, Milutinovic AS, et al. Alpha-1-antitrypsin phenotypes in adult liver disease patients. Ups J Med Sci. 2009;114(4):228-34.
- Teckman JH. Liver disease in alpha-1 antitrypsin deficiency: current understanding and future therapy. COPD. 2013;10 Suppl 1:35-43.



genotypes sups
*Hay más de 100 alelos identificados de SERPINA1, incluidos muchos que no producen AAT (alelos «null»)1,2
†El alelo PiZ da lugar a la polimerización intracelular de la AAT, lo que puede provocar la lesión y la muerte de los hepatocitos. El alelo PiS provoca una rápida degradación intracelular de la AAT. El alelo PiS se asocia a un déficit de AAT más leve y un mayor riesgo de hepatopatía cuando es coheredado con PiZ (por ejemplo, PiSZ).7,8
‡El mantenimiento de los niveles séricos del inhibidor proteinasa (Pi) alfa-1 antitripsina (AAT) (medidos antigénicamente) por encima de 11 μM (o de 60 mg/dL por nefelometría), considerado un umbral de protección, se ha postulado históricamente para proporcionar una protección de la elastasa de neutrófilo pertinente desde el punto de vista terapéutico, aunque esto no se ha demostrado.2 Un umbral de confirmación de 20 μM (113mg/dl) de AAT detectará PiMZ, PiSZ, PiMS y PiSS con alta sensibilidad y especificidad.
AAT: alfa-1 antitripsina.